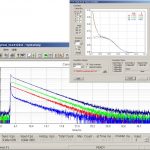
Система счета единичных фотонов HydraHarp 400
Масштабируемая мультиканальная система коррелированного по времени счета единичных фотонов (TCSPC) high-end класса и анализатор временных интервалов (TIA).
Система счета единичных фотонов HydraHarp 400
Мультиканальный пикосекундный временных интервалов & TCSPC модуль
- Компактная устройство с USB 3.0 и модульным, масштабируемым дизайном;
- До 8 независимых входных каналов и основной канал синхронизации (до 150 MHz);
- Максимальное количество временных слотов гистограмм - 65536, минимальное время накопления шага - 1 пс;
- Скорость счета до 12.5 млн ед/сек на канал;
- Регулируемых входной отклик для каждого канала с разрешением 1 пс;
- Диапазон измерений гистограмм от 65 нс до 2.19 с;
- Фиксация времени поддерживающая скорость счета на уровне 40 MHz;
- Внешняя синхронизация в процессе съемки (время жизни флуоресценции);
- Вход и выход внешних опорных тактовых сигналов.
HydraHarp 400 поддерживает следующие режимы:
- Integration mode;
- Oscilloscope mode;
- Time-Resolved Emission Spectra (TRES);
- Time-Tagged Time-Resolved mode (TTTR;)
- On-line («real-time») correlator для FCS.
Система счета единичных фотонов HydraHarp 400 может быть использована в различных методах, которые требуют мультиканальную систему коррелированного по времени счета единичных фотонов (TCSPC) и/или систему фиксации времени с независимыми каналами, таких как:
- Флуоресценция с временным разрешением (Time-Resolved Fluorescence);
- Визуализация времени жизни флуоресценции (Fluorescence Lifetime Imaging, FLIM);
- Визуализация времени жизни фосфоресценции (Phosphorescence Lifetime Imaging, PLIM);
- Флуоресцентная корреляционная спектроскопия (Fluorescence Correlation Spectroscopy, FCS);
- Корреляционная спектроскопия времени жизни флуоресценции (Fluorescence Lifetime Correlation Spectroscopy, FLCS);
- Фёрстеровский перенос энергии (Foerster Resonance Energy Transfer (FRET);
- Микроскопия на эффекте вынужденного подавления флуоресценции (Stimulated Emission Depletion Microscopy, STED);
- Анизотропия флуоресценции (Fluorescence Anisotropy, Polarization);
- Одномолекулярная спектроскопия (Single Molecule Spectroscopy / Detection);
- Измерение синглетного кислорода (Singlet Oxygen);
- Время разрешенная фотолюминесценция (Time-Resolved Photoluminescence, TRPL);
- Временная спектроскопия аннигиляции позитронов (Positron Annihilation Lifetime Spectroscopy, PALS).
| Input Channels and Sync | |
|---|---|
| Разрешающая способность | Дискриминатор с постоянным порогом (CFD) во всех каналах, приспосабливаемое программное обеспечение |
| Входное напряжение | от 0 мВ до -1000 мВ, оптимальный режим: от -100 мВ до -500 мВ |
| Точка срабатывания | задний фронт |
| Время необходимое для подъема/падения триггера импульса | максимум 2 нс |
| Внешний опорный тактовый генератор | |
| Вход | 10 MHz, min. 200 mV, max. 1 V pp, 50 Ohms, AC coupled |
| Выход | 10 MHz, 300 mV pp, 50 Ohms, AC coupled |
| Time to Digital Converters | |
| Минимальное время накопления шага | 1 пк |
| Временное разрешение | до < 12 пк (ср.квадр.) |
| Полный диапазон измерений в режиме «histogram mode» | от 65 нс до 2.19 с (в зависимости от выбранного разрешения : 1, 2, 4, …, 33 554 432 пс) |
| Полный диапазон измерений в режиме «time-tagged mode» | infinite |
| Максимальная скорость счета на входной канал | 12.5 × 106 ед/сек |
| Максимальная скорость синхронизации | 150 MHz |
| Регулируемый диапазон задержки для каждого входного канала | ± 100 нс, разрешение 1 пс |
| Мертвое время | до < 80 нс |
| Дифференциальная нелинейность | < 2 % пика, < 0.2 % ср.квадр. (в полном диапазоне измерения) |
| Гистограммы | |
| Единицы к количеству временных слотов | 4.294.967.296 (32 bit) |
| Максимальное количество временных слотов | 65536 |
| Время захвата | от 1 мс до 100 часов |
| TTTR Процессор | |
| Разрешение в режиме T2 | 1 пс |
| Разрешение в режиме T3 | 1, 2, 4, …, 33 554 432 пс |
| FiFo buffer depth (records) | 2097152 |
| Пропускная способность (сумма всех каналов) | typ. 40 × 106 ед/сек (в зависимости от конфигурации ПК и эксплуатации) |
| Управление | |
| Интерфейс ПК | USB 3.0 |
| Требования ПК | min. 1 GHz CPU clock, min. 1 GB memory |
| Операционная система | Windows 8/10 |
| Потребляемая мощность | small mainframe < 50 W, large mainframe < 100 W at 100 to 240 VAC |
- Precision and accuracy of single-molecule FRET measurements—a multi-laboratory benchmark study;
Hellenkamp B., Schmid S., Doroshenko O., Opanasyuk O., Kühnemuth R., Rezaei Adariani S., Ambrose B., Aznauryan M., Barth A., Birkedal V., Bowen M.E., Chen H., Cordes T., Eilert T., Fijen C., Gebhardt C., Götz M., Gouridis G., Gratton E., Ha T., Hao P., Hanke C.A., Hartmann A., Hendrix J., Hildebrandt L.L., Hirschfeld V., Hohlbein J., Hua B., Hübner C.G., Kallis E., Kapanidis A.N., Kim J.Y., Krainer G., Lamb D.C., Lee N.K., Lemke E.A., Levesque B., Levitus M., McCann J.J., Naredi-Rainer N., Nettels D., Ngo T., Qiu R., Robb N.C., Röcker C., Sanabria H., Schlierf M., Schröder T., Schuler B., Seidel H., Streit L., Thurn J., Tinnefeld P., Tyagi S., Vandenberk N., Vera A.M., Weninger K.R., Wünsch B., Yanez-Orozco I.S., Michaelis J., Seidel C.A.M., Craggs T.D., Hugel T. Nature Methods, Vol.009, p.669-676 (2018). - Label-free monitoring of ambient oxygenation and redox conditions using the photodynamics of flavin compounds and transient state (TRAST) spectroscopy;
Tornmalm J., Widengren J. Methods, Vol.140-141, p.178-187 (2018). - Fluorescence lifetime correlation spectroscopy: basics and applications;
Ghosh A., Karedla N., Thiele J.C., Gregor I., Enderlein J. Methods, Vol.140-141, p.32-39 (2018). - Reducing phonon-induced decoherence in solid-state single-photon sources with cavity quantum electrodynamics;
Grange T., Somaschi N., Antón C., De Santis L., Coppola G., Giesz V., Lemaître A., Sagnes I., Auffèves A., Senellart P. Physical Review Letters, Vol.118, 253602 (2017). - Nanomaterials for triplet exciton transfer into silicon;
Verboom S. Dissertation Wageningen University (2017). - High-speed switching of biphoton delays through electro-optic pump frequency modulation featured;
Odele O.D., Lukens J.M., Jaramillo-Villegas J.A., Imany P., Langrock C., Fejer M.M., Leaird D.E., Weiner A.M. APL Photonics, Vol.002, 011301 (2017). - Frequency domain processing of on-chip biphoton frequency comb;
Jarmillo-Villegas J.A., Imany P., Odele O.D., Leaird D.E., Ou Z.-Y., Qi M., Weiner A.M. Optica, Vol.004, p.655-658 (2017). - The nematode homologue of Mediator complex subunit 28, F28F8.5, is a critical regulator of C. elegans development;
Kostrouchová M., Kostrouch D., Chughtai A.A., Kaššák F., Novotný J.P., Kostrouchová V., Benda A., Krause M.W., Saudek V., Kostrouchová M., Kostrouch Z. PeerJ Preprints, Vol.006, e3390 (2017). - Carbon nanodots with sub-nanosecond spontaneous emission lifetime;
Liu C.-W., Lin T.-N., Chang l.-Y.,Jiang Z.-C., Shen J.-L., Chen P.-W., Wang J.-S., Yuan C.-T. ChemPhysChem, Vol.018, 42-46 (2017). - Pulsed single-photon spectrometer by frequency-to-time mapping using chirped fiber Bragg gratings;
Davis A.O.C., Saulnier P.M., Karpiński M., Smith B.J. Optics Express, Vol.025, p.12804-12811 (2017).