Система экспресс-анализа качества белков Nanotemper Tycho
Nanotemper Tycho определяет качество, сходство и функциональность белка за 3 минуты с использованием нескольких мл образца с Tycho. Сделайте Ваши процессы разработки, анализа и очистки белка более эффективными.
Определяет, какие партии, буферы или условия являются лучшими, сравнивая стабильность и сходство каждого образца на каждом этапе эксперимента. Следит за температурными перепадами (Ti) или результатом денатурации - важными показателями стабильности белка.
На выходе вы получите ценную информацию о функциональности, чистоте, концентрации и даже сходстве вашего белка с предыдущими партиями, используя всего 10 микролитров образца за один эксперимент.
Система Tycho представляет собой дифференциальный сканирующий флуориметр, который измеряет флуоресценцию собственных остатков тирозина и триптофана в образцах (пептидов/белков). Полученные данные важны при проверке экспрессии, очистки и определении функций белков, изменение внутренней флуоресценции контролируется в диапазоне температур от 35 до 95 °С.
Полученные в результате данные могут быть использованы для сравнения экспериментальных партий образцов, анализа фракций во время очистки пептидов/белков, для определения надлежащих условий хранения/анализа и функциональности (то есть связывания лигандов и т.д.), анализа жидких биофармацевтические препаратов, изучения стабильности белков и фолдинга.
Максимальное количество образцов за эксперимент: до 6
Время эксперимента: 3 минуты
Измеренный объем образца: 10 мкл
Детектируемый диапазон концентраций молекул (стандартный IgG): от 0.010 до > 200 мг/мл
Динамический диапазон концентрации молекулы в пределах одного цикла: 500-кратная разница в концентрации (стандартный IgG)
Выходные данные:
- Температура перегиба кривой (Ti);
- Исходное соотношение 350 нм/330 нм при 35 °C;
- Изменение соотношения 350 нм/330 нм (Δ) между 95 °C и 35 °C;
- Яркость образца.
Воспроизводимость результатов Ti* (при 70 °C):
- Стандартное отклонение <0,15 °C;
- Относительное стандартное отклонение <0,2%.
ΔTi * для получения достоверного результата: ± 0.3 °C
Диапазон нагрева: от 35 °C до 95 °C
Температурный рампинг: 30 °C/мин
Точность крутизны температурной кривой: ± 0.05 °C/мин
Детекция флуоресценции: 330 ± 5 нм и 350 ± 5 нм
Источник флуоресценции: автофлуоресценция триптофана и/или тирозина
Размеры: 31 см Ш x 37 см В x 18 см Г
Вес: 6.6 кг
Диапазон разбавления для точной индикации концентрации: от 0.010 до >1 мг/мл
Метод nanoDSF предлагает множество преимуществ по сравнению с традиционными методами флуориметрии. В отличие от стандартной дифференциальной сканирующей флуориметрии, nanoDSF не требует использования флуоресцентных красителей, таких как Sypro Orange.
- Низкое потребление образца → требуется всего 10 мкл образца;
- Свободный выбор буферов для анализа → возможны также биологические жидкости, такие как сывороточный или клеточный лизат и другие добавки/детергенты;
- Очень короткое время анализа → обеспечивает высокую пропускную способность за 3 минуты;
- Оптимальное качество данных и разрешение → двойное УФ-обнаружение на длинах волн 350/330 нм;
- Широкий диапазон температур → возможен анализ от 15°C до 95°C;
- Не требуется маркировка → возможен непосредственный анализ;
- Широкий диапазон концентраций от 0.010 до 200 мг/мл;
- Широкий диапазон размеров молекул → от 1 кДа до 1 МДа.
NanoDSF — метод нано-дифференциальной сканирующей флуориметрии, способен анализировать конформационную и коллоидную стабильность (поведение при агрегации) белков в различных термических и химических условиях. Конформационная стабильность белка описывается его средней температурой денатурации Tm (°C), которая является точкой, где разворачивается половина белка.
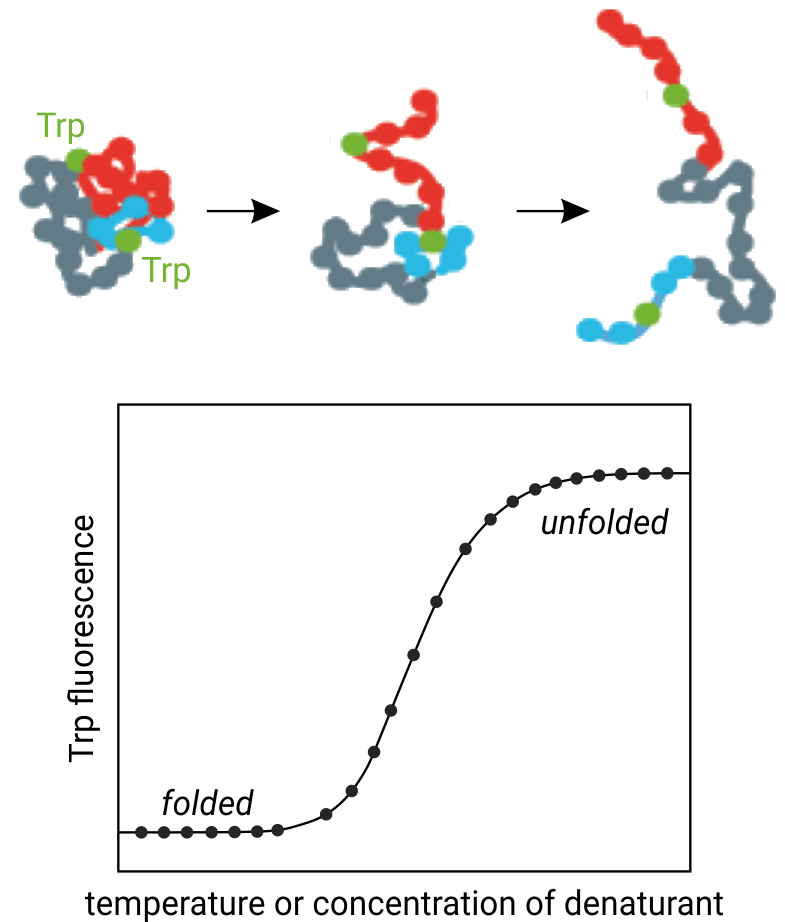
Техника nanoDSF детектирует внутреннюю флуоресценцию триптофана и тирозина белков на длинах волн 330/350 нм. Взаимная интенсивность пиков чувствительна к изменению конформации белка и меняется при термической денатурации. Образцы можно нагревать до любой температуры в диапазоне от 35°С до 95°С. Важно отметить, что для эксперимента не требуются красители и нет ограничений по использованию буфера.
Eschbach, J., Elliott, J., Li, W., et al., BioRxiv 2020 doi: 10.1101/2020.03.26.009902
Molecular basis for the binding and selective dephosphorylation of Na+/H+ exchanger 1 by calcineurin
Ruth Hendus-Altenburger, Xinru Wang, Lise M. Sjøgaard-Frich, Elena Pedraz-Cuesta, Sarah R. Sheftic, Anne H. Bendsøe, Rebecca Page, Birthe B. Kragelund, Stine F. Pedersen & Wolfgang Peti, Nature Communications 2019 Aug 2;10(1):3489. doi: 10.1038/s41467-019-11391-7
Thermal unfolding and refolding of a lytic polysaccharide monooxygenase from Thermoascus aurantiacus
Raushan K. Singha , Benedikt M. Blossom, D. A. Russo , B. van Oort, R. Croce, P. E. Jensen, C. Felby, M. J. Bjerrum, RSC Advances 2019 issue: 51 doi: 10.1039/C9RA05920B
Kinetic and structural analysis of human ALDH9A1
Radka Končitíková, Armelle Vigouroux, Martina Kopečná, Marek Šebela, Solange Moréra, David Kopečný, Bioscience Reports 2019 Apr 30 doi: 10.1042/BSR20190558
Meisam Nosrati, Debayan Dey, Atousa Mehrani, Sarah E. Strassler, Natalia Zelinskaya, Eric D. Hoffer, Scott M. Stagg, Christine M. Dunham, Graeme L. Conn, Journal of Biological Chemistry 2019 doi: 10.1074/jbc.RA119.011181
A click‐chemistry linked 2′3′‐cGAMP analogue
Dialer, Clemens Reto, Samuele Stazzoni, David Jan Drexler, Felix Moritz Müller, Simon Veth, Alexander Pichler, Hidenori Okamura, Gregor Witte, Karl‐Peter Hopfner, and Thomas Carell, Chemistry 2019 Feb 6;25(8):2089-2095. doi: 10.1002/chem.201805409
Engineering ClpS for selective and enhanced N-terminal amino acid binding
Jennifer Tullman, Nicholas Callahan, Benjamin Ellington, Zvi Kelman, and John P. Marino, Applied Microbiology and Biotechnology 2019 Mar;103(6):2621-2633. doi: 10.1007/s00253-019-09624-2
Lnc-EPB41-protein interactions associated with congenital pouch colon
Sonal Gupta, Nidhi Gupta, Pradeep Tiwari, Saji Menon, Praveen Mathur, Shanker Lal Kothari, Sivaramaiah Nallapeta, Krishna Mohan Medicherla, and Prashanth Suravajhala, Biomolecules. 2018 Sep; 8(3): 95. doi: 10.3390/biom8030095
Human and mouse albumin bind their respective neonatal Fc receptors differently
Jeannette Nilsen, Malin Bern, Kine Marita Knudsen Sand, Algirdas Grevys, Bjørn Dalhus, Inger Sandlie & Jan Terje Andersen, Scientific Reports 2018 vol: 8 Article number: 14648 doi: 10.1038/s41598-018-32817-0




