Система NanoTemper Prometheus
Система Prometheus для изучения конформационной и термической стабильности белков, анализа химической денатурации и агрегации на основе технологии nanoDSF.
Система Prometheus точно характеризуют термическую и химическую денатурацию, агрегацию. В своих исследованиям Вы сможете получить точные температуры денатурации (Tm и Tonset), критические денатурирующие концентрации (Cm), энергии свободного сворачивания (ΔG и ΔΔG) и результаты агрегации (Tagg).
Система Prometheus на основе nanoDSF идеально подходит для:
- Скрининга буферов, рецептурных и буферных добавок, детергентов;
- Анализа термической и химической денатурации белка;
- Долгосрочная оптимизации хранения белков и антител;
- Тестов на устойчивость к принудительному разложению;
- Сравнения биоподобных белков и антител по стабильности и агрегации;
- Сплошного анализа партии;
- Анализа большого количества параметров (влияние мутаций, модификаций, конъюгаций на стабильность и агрегацию белка).
Количество образцов за цикл:
- для Prometheus NT.48: до 48 (одиночные капилляры);
- для Prometheus NT.Plex: до 24 (капиллярный чип);
- для Prometheus NT.Plex plus NT.Robotic Autosampler: до 1536 образцов (до 64 капиллярных чипов).
Требуемый объем образца: 10 мкл
Диапазон обнаруживаемых концентраций молекул: 0,005 – 250 мг/мл (стандартный IgG)
Время проведения эксперимента — термическая денатурация (от 1 °C/мин до 7 °C/мин):
- для Prometheus NT.48 и Prometheus NT.Plex: от 18 до 75 минут;
- для Prometheus NT.Plex plus NT.Robotic Autosampler: от 4 часов до ночи (384 образца).
Точность определения точки перегиба кривой при 75 °C: ± 0,1 °С
Точность/воспроизводимость отношения: 0,008
Время проведения эксперимента — химическое развертывание:
- для Prometheus NT.48 и Prometheus NT.Plex: 1 минута;
- для Prometheus NT.Plex plus NT.Robotic Autosampler: до 27 минут (384 образца).
Точность теплового перехода 1 °С/мин: ± 0,2 °С
Термоконтроль:
- Варианты выбора: от 0,1 °С/мин до 7 °С/мин;
- Диапазон температур: 15 – 95 °С (при температуре окружающей среды 25 °С).
Регистрация флуоресценции: 330 нм и 350 нм
Размеры:
- для Prometheus NT.48 и Prometheus NT.Plex: 35 см Ш x 51 см В x 52 см Г;
- для Prometheus NT.Plex plus NT.Robotic Autosampler: 110 см Ш x 188 см В x 90 см Г.
Вес:
- для Prometheus NT.48 и Prometheus NT.Plex: 30 кг;
- для Prometheus NT.Plex plus NT.Robotic Autosampler: 200 кг.
Дополнительные возможности:
- Оптика для обнаружения агрегации;
- Повышение температуры до 15 – 110 °C (при температуре окружающей среды 25 °C);
- Программное обеспечение, соответствующее 21 CFR part 11.
Метод nanoDSF предлагает множество преимуществ по сравнению с традиционными методами флуориметрии. В отличие от стандартной дифференциальной сканирующей флуориметрии, nanoDSF не требует использования флуоресцентных красителей, таких как Sypro Orange.
- Низкое потребление образца → требуется всего 10 мкл образца;
- Свободный выбор буферов для анализа → возможны также биологические жидкости, такие как сывороточный или клеточный лизат и другие добавки/детергенты;
- Очень короткое время анализа → обеспечивает высокую пропускную способность;
- Оптимальное качество данных и разрешение → двойное УФ-обнаружение на длинах волн 350/330 нм;
- Широкий диапазон температур → возможен анализ от 15 °C до 110 °C;
- Не требуется маркировка → возможен непосредственный анализ;
- Широкий диапазон концентраций от 5 мкг/мл до 200 мг/мл;
- Широкий диапазон размеров молекул → от 1 кДа до 1 МДа.
NanoDSF — метод нано-дифференциальной сканирующей флуориметрии, способен анализировать конформационную и коллоидную стабильность (поведение при агрегации) белков в различных термических и химических условиях. Конформационная стабильность белка описывается его средней температурой денатурации Tm (°C), которая является точкой, где разворачивается половина белка. Техника nanoDSF детектирует внутреннюю флуоресценцию триптофана белков, которая очень чувствительна и изменяется при термическом разворачивании.
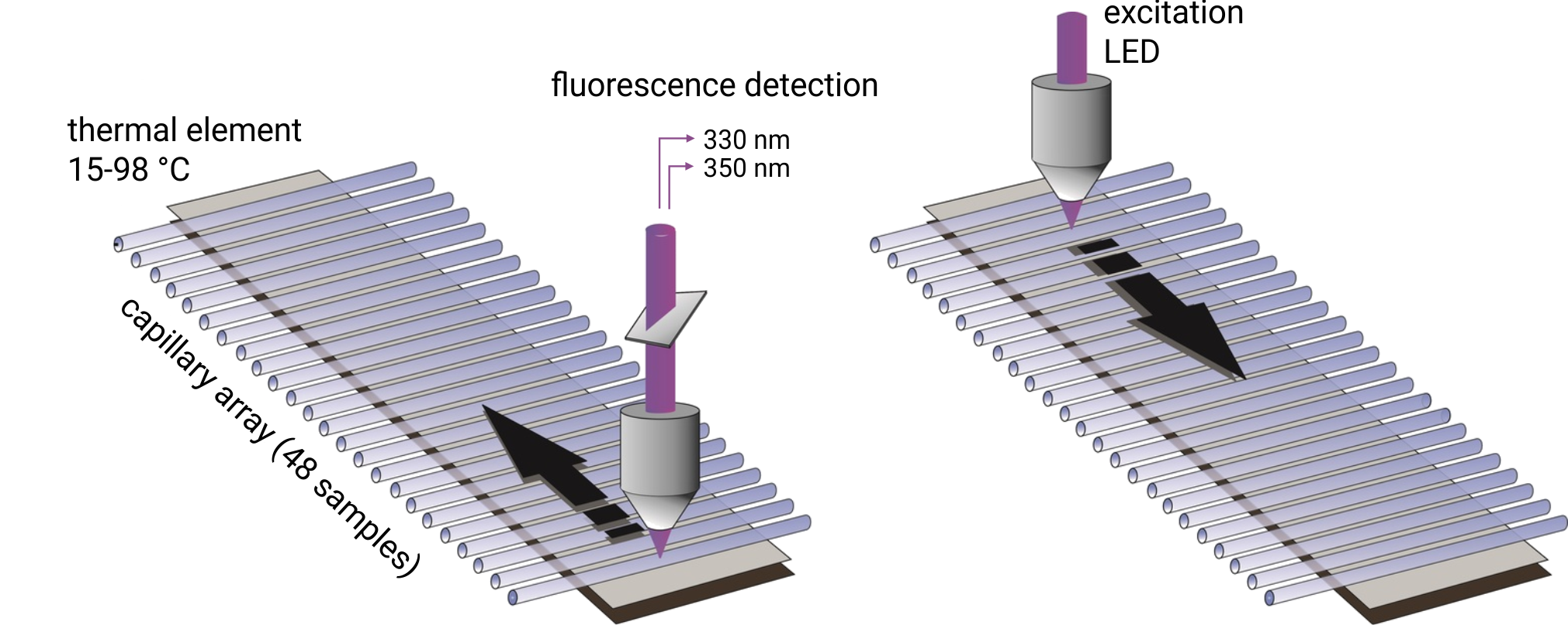
До 48 капилляров заполняются 10 мкл образца и одновременно сканируются на длинах волн 330/350 нм. Температуры плавления регистрируются путем мониторинга изменений собственной флуоресценции триптофана, а температуры начала агрегации регистрируются с помощью рассеяния света с обратным отражением. Образцы могут быть нагреты до любой температуры в диапазоне от 25 °С до 95 °С. Важно отметить, что образцы могут быть изучены без использования красителя и со свободным выбором буфера. Температуры плавления белков с концентрацией от 5 мкг/мл до 250 мг/мл могут быть проанализированы. Для получения высоких температур начала агрегации требуются белковые растворы с концентрациями выше 1 мг/мл.
NanoDSF (нано-дифференциальная сканирующая флуориметрия) — это быстрый, надежный, высококачественный метод, не требующий флуоресцентных меток и растворов для анализа стабильности белка, термической денатурации белка и анализа температуры плавления на основе собственной флуоресценции триптофана. NanoDSF является отличным инструментом для скрининга буферов и детергентов, а также позволяет анализировать коллоидную стабильность растворов белков (агрегацию).
В целом, собственная флуоресценция триптофана белков сильно зависит от их 3D-структуры и, следовательно, от локального окружения остатков триптофана. При использовании химических денатуратов или термического градиента белки могут быть развернуты, что приводит к изменениям собственной флуоресценции триптофана. Это приводит к сдвигу пиков флуоресцентного излучения и изменениям интенсивности. NanoDSF отслеживает эти флуоресцентные изменения с высоким временным разрешением и может выявить даже несколько разворачивающихся переходов. Поэтому NanoDSF весьма успешен в разработке антител, характеристике мембранных белков, контроле качества белка, скрининге буфера, анализе разворачивания белка и скрининге связывания низкомолекулярных соединений.
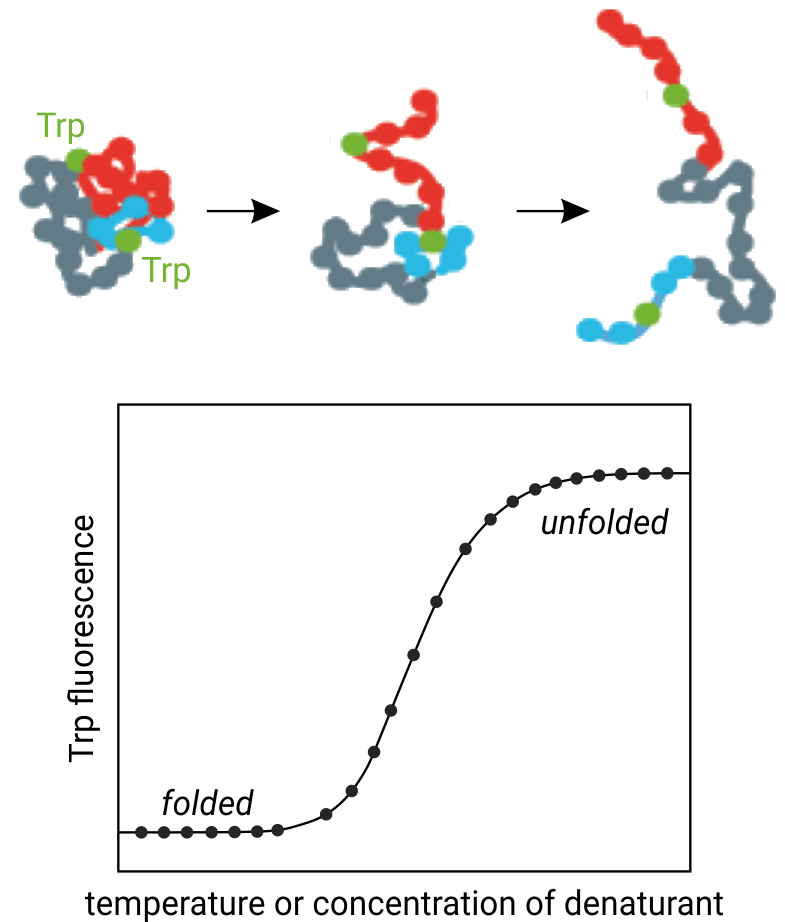
Рисунок 1. Принцип, лежащий в основе термической денатурации белка: повышение температуры вызывает денатурацию третичной структуры белка и, таким образом, остатки триптофана, подвергаются воздействию растворителя. NanoDSF отслеживает параллельные изменения флуоресценции триптофана на длинах волн 330 и 350 нм.
Для обнаружения агрегации белка система Prometheus имеет оптику с обратным отражением. Обычно видимый свет проходит через капилляры, содержащие образец интересующего белка, без каких-либо помех, отражается зеркалом на капиллярном поддоне и, наконец, количественно определяется детектором. Если образец белка содержит агрегированные частицы, падающий свет рассеивается этими частицами. Потеря интенсивности отражения является точным показателем агрегации белка.
Stability liabilities of biotherapeutic proteins: Early assessment as mitigation strategy
Lobo, S., Baczyk, P., Wyss, B., et al., Journal of Pharmaceutical and Biomedical Analysis 2021, vol: 192 doi: 10.1016/j.jpba.2020.113650
Saikia, A. and Springer, S., Molecular Immunology 2021, vol: 136 doi: 10.1016/j.molimm.2021.04.028
Understanding unfolding and refolding of the antibody fragment (Fab). I. In-vitro study
Gani, K., Bhambure, R., Deulgaonkar, P., et al., Biochemical Engineering Journal 2020, vol: 164 doi: 10.1016/j.bej.2020.107764
Joshi, S., Maharana, C., Rathore, A., Journal of Pharmaceutical and Biomedical Analysis 2020, vol: 186 doi: 10.1016/j.jpba.2020.113270
Hauser, A., Carnell, G., Held, K., et al., Vaccines 2021, vol: 9(7) doi: 10.3390/vaccines9070750
Kang, Y., Sun, C., Zhuang, Z., et al., ACS Nano 2021, vol: 15(2) doi: 10.1021/acsnano.0c08379
Norrild, R., Vettore, N., Coden, A., et al., Biophysical Chemistry 2021, vol: 271 doi: 10.1016/j.bpc.2021.106549
Rumachik, N., Malaker, S., Poweleit, N., et al., Methods and Clinical Development 2020, vol: 18(11) doi: 10.1016/j.omtm.2020.05.018
Gervais, D., Hayzen, J., Orphanou, C., et al., Enzyme and Microbial Technology 2017, vol: 98 doi: 10.1016/j.enzmictec.2016.12.003
Bee, J., O’Berry, K., Zhang, Y., et al., Journal of Pharmaceutical Sciences 2021, doi: 10.1016/j.xphs.2021.06.010




