Система анализа аффинностей NanoTemper Monolith
Система анализа аффинностей межмолекулярных взаимодействий на основе метода микроскопического термофореза.
Микроскопический термофорез (МСТ) основан на измерении подвижности молекул в температурном градиенте. Образование комплекса молекулы с лигандом приводит к изменению свойств молекулы: заряда, размера, гидратной оболочки и т.д. Это влияет на термофоретическую подвижность. Сопоставляя термофоретические кривые для молекул при разной концентрации лиганда, программное обеспечение вычисляет константу диссоциации, характеризующую силу взаимодействия молекулы с лигандом (аффинность).
Метод МСТ позволяет делать точные количественные оценки самых разных бимолекулярных взаимодействий (например, белок–лиганд, белок–белок, белок–нуклеиновая кислота и т.д.). Измерения можно проводить непосредственно в биологических жидкостях, что приближает условия к естественным, исключает необходимость иммобилизации молекул и просто экономит время. Всё это делает микроскопический термофорез привлекательным методом как для фундаментальных исследований, так и для биомедицинских приложений.
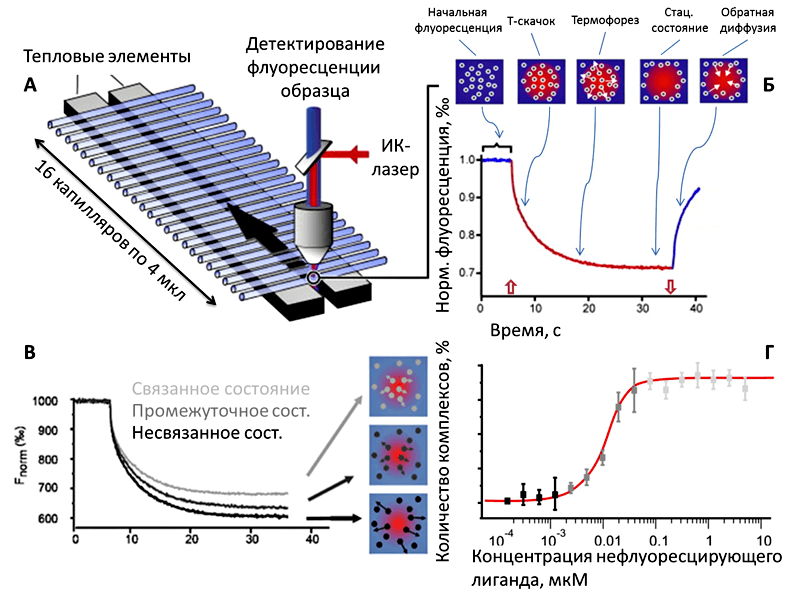
А — Раствор с исследуемыми флуоресцирующими молекулами помещают в капилляры по 4 мкл. В каждый капилляр добавляют молекулу-партнёр (нефлуоресцирующую) в разных концентрациях. Регистрируют начальную флуоресценцию, чтобы определить точные координаты капилляров.
Б — Регистрируют термофоретическую кривую (показана кривая для 1 капилляра). Для этого капилляр освещают ИК-лазером (включение и выключение ИК-лазера обозначено красной стрелкой вверх и вниз соответственно). Наблюдается температурный скачок (Т-скачок) в течение 1 с. После этого начинается термофорез, и в течение 25-30 с система приходит в стационарное состояние. После выключения лазера наблюдается обратная диффузия. Наверху показана схема движения молекул (белые кружки) во время разных фаз термофореза. Красным цветом выделена область освещения ИК-лазером. Кривая представляет собой зависимость нормированной флуоресценции (Fnorm, ‰) от времени.
В — Аналогичную операцию проводят с остальными капиллярами. Черным цветом показана кривая, характерная для капилляра с нулевой концентрацией молекулы-партнёра. Темно-серым — для капилляра, в котором концентрация молекулы-партнёра была недостаточна для связывания со всеми молекулами. Серым — для капилляра с полностью связанными молекулами. Справа изображена схема движения молекул: черные кружки обозначают несвязанные молекулы, которые быстро «разбегаются» при нагревании, серые кружки — комплексы (обладают большей массой или зарядом и потому медленнее покидают область нагрева).
Г — После измерения обрабатывают результаты. Значения Fnorm пересчитывают в количество связанных молекул, или комплексов (%), и на графике откладывают относительно концентрации молекулы-партнёра.
| Фаза | Что влияет на фазу? | Что можно определить по фазе? |
|---|---|---|
| Т-скачок | Изменение собственной флуоресценции метки в результате изменения микроокружения при образовании комплекса | Число комплексов, «жесткость» структуры |
| Термофорез | Всё, что изменяет коэффициент диффузии и термофоретическую подвижность молекул: размер, заряд, изменения в гидратной оболочке и др. | Число комплексов |
| Обратная диффузия | Гидродинамический радиус | Размер молекул |
| Конвекция | Масса молекул | Агрегация |
Время эксперимента: не более 10 минут
Динамический диапазон:
- для Monolith: от 1 нM до мM;
- для Monolith Pico: от 1 пM до мM;
- для Monolith LabelFree: от 10 нM до мM;
- для Monolith NT.Automated: от 1 пМ до мМ.
Диапазон молекул:
- Молекулярный вес : 101–107 Да;
- Размер: 0.1 нм – 1 мкм.
Максимальное количество образцов за эксперимент:
- для Monolith, Monolith Pico и Monolith LabelFree: до 24;
- для Monolith NT.Automated: до 96.
Минимальный измеренный объем образца:
- для Monolith, Monolith Pico и Monolith LabelFree: 4 мкл;
- для Monolith NT.Automated: 3 мкл.
Термоконтроль: от 20 до 40ᵒC (± 0.5ᵒC)
Каналы флуоресценции:
- для Monolith: 2 (RED & LabelFree (UV), RED & BLUE, RED & GREEN или BLUE & GREEN);
- для Monolith Pico: 1 (pico RED) или 2 (pico RED & LabelFree (UV) или pico RED & BLUE);
- для Monolith LabelFree: 1 (LabelFree (UV));
- для Monolith NT.Automated: 4 (BLUE, GREEN, RED, pico RED и UV)).
Размеры:
- для Monolith, Monolith Pico и Monolith LabelFree: 36 см Ш x 40 см В x 58 см Г;
- для Monolith NT.Automated: 83 см Ш х 63 см В х 57 см Г.
Вес:
- для Monolith, Monolith Pico и Monolith LabelFree: 27 кг;
- для Monolith NT.Automated: 70 кг.
Monolith на основе МСТ обладает рядом преимуществ перед другими методами определения аффинности:
- Требуется малая концентрация образца;
- Можно исследовать взаимодействие молекул в условиях, близких к естественным: клеточном лизате и сыворотке крови;
- Можно исследовать взаимодействие практически любых молекул: от ионов до белковых агрегатов, взаимодействие белков с нуклеиновыми кислотами, фосфолипидами, ионами;
- Быстро, просто; константа диссоциации рассчитывается автоматически.
Метод микроскопического термофореза (МСТ, англ. microscale thermophoresis, MST) основан на движении молекул в градиенте температур (греч. Θερμη — тепло, φορεω — переношу). Температурный градиент достигается освещением капилляра с исследуемыми молекулами инфракрасным лазером. В зоне нагрева частицы движутся быстрее и «расталкивают» друг друга. Поэтому поток частиц устремляется в более холодные области капилляра (рис. 1), и их концентрация в зоне нагрева снижается (рис. 2). Изменение концентрации регистрируют по снижению флуоресценции в зоне нагрева. По сути, с помощью МСТ измеряют динамику изменения концентрации молекул в зоне нагрева.
Метод позволяет определять наличие комплексов и силу взаимодействия молекул, потому что связывание молекул друг с другом приводит к изменению их подвижности в температурном градиенте.

Рисунок 1. Схематичное представление термофоретического дрейфа молекул. Молекулы показаны белыми кружками. Температурный градиент представлен в псевдоцветах: красным показана холодная область, желтым — горячая.
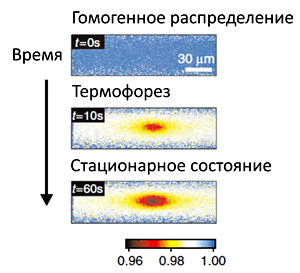
Рисунок 2. Изменение концентрации молекул в различных зонах капилляра при нагреве. На верхней панели — гомогенное распределение молекул в капилляре до включения ИК-лазера. После включения лазера происходит локальный нагрев содержимого капилляра, и молекулы «разбегаются» в стороны, в более холодные участки капилляра (средняя панель). Через 30-60 с система приходит в равновесие (нижняя панель). Шкала отражает относительное количество молекул в исследуемом объеме. Синий цвет — 100%, желтый — 98%, красный — 96%.
MST and TRIC technology to reliably study PROTAC binary and ternary binding in drug development
Bartoschik, T., Zoephel, A., Rumpel, K., et al., Methods in Molecular Biology 2021, doi: 10.1007/978-1-0716-1665-9_6
Bartoschik, T., Gupta, A., Kern, B., et al., Biophysics of Membrane Proteins 2021, vol: 2168 doi: 10.1007/978-1-0716-0724-4_2
Nieto, G., Jara, R., Watterson, D., et al., Nature 2021, vol: 11 doi: 10.1038/s41598-021-82833-w
Sweet and blind spots in E3 ligase ligand space revealed by a thermophoresis-based assay
Maiwald, S., Heim, C., Alvarez, B., et al., ACS Medicinal Chemistry Letters 2020, doi: 10.1021/acsmedchemlett.0c00440
Термофорез: [biomolecula.ru] (дата обращения: 11.07.2019)




