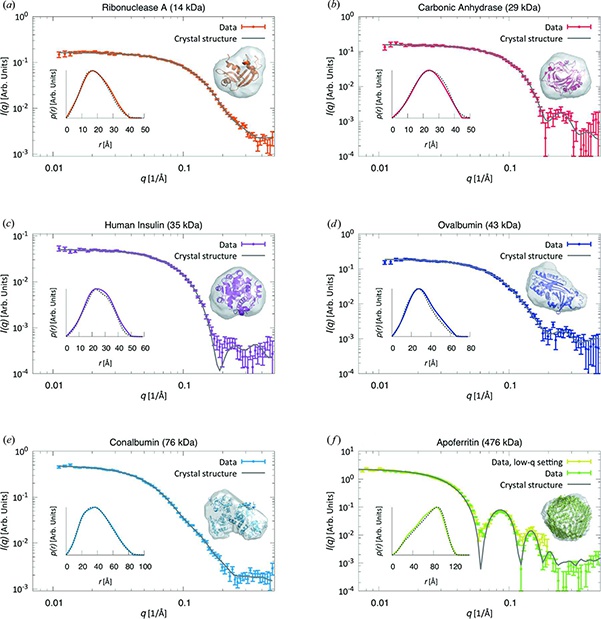
Значительное увеличение производительности биоструктурных исследований может быть достигнуто за счет устранения необходимости поездок на синхротрон для использования комбинации SAXS с SEC (хроматографией исключения по размеру). В недавней публикации в журнале «Applied Crystallography» Saskia Bucciarelli (группа Bente Vestergaard) и партнеры из Копенгагенского университета показывают, как они получили структурные детали водорастворимых белков с использованием этой комбинации методов. Использование SEC-SAXS является популярным методом на синхротронных пучках. Это позволяет исследователям анализировать структуру нестабильных образцов, таких как лабильные белки и комплексы с низкой аффинностью связывания, которые разваливаются при хранении или при транспортировке к синхротрону.
В сотрудничестве с Xenocs исследователи демонстрируют, что для ряда различных белков они получают данные, которые имеют достаточно высокое качество для извлечения структурной информации, и в то же время они могут работать с объемами образцов размером до 5 мкл — точно так же, как на синхротроне! Одновременно со сбором данных SAXS измеряется поглощение в УФ и видимой области спектра, что позволяет точно измерять концентрацию образца, что в свою очередь имеет важное значение для определения молекулярного веса.
SEC-SAXS в лаборатории не только дает результаты, сопоставимые с синхротронными данными, но и дает дополнительные возможности. При использовании синхротронного излучения часто, если не всегда, образец разрушается от радиационных повреждений. В лаборатории этого не происходит, поэтому ученые могут использовать образец после измерений и проводить дополнительные анализы.
С оригиналом новости вы можете ознакомиться по следующей ссылке.
