Данная статья раскрывает понятие аффиннности, ее принципы и применение. В статье мы рассмотрим различные методы ее определения с плюсами и минусами.
Аффинность в биохимии – это сила взаимодействия между биомолекулой (лигандом) и молекулой—партнёром (аналитом). Наиболее важной характеристикой аффинности является равновесная константа диссоциации (Kd). В простейшем случае, при связывании 1:1, она отвечает такой концентрации аналита, при которой 50% молекул лиганда находится в связанном состоянии. Иными словами, Kd даёт информацию о том, образуется ли молекулярный комплекс при заданных концентрациях субстратов; чем она меньше, тем выше аффинность.
Необходимость определять аффинность возникает и в фундаментальных, и в прикладных исследованиях. При изучении внутриклеточных процессов нужно учесть и охарактеризовать огромное число взаимодействий между тысячами различных молекул. Это становится возможным благодаря современным высокопроизводительным методам определения аффинности. Кроме того, измерение аффинности – это неотъемлемая часть процесса разработки лекарств. На начальных этапах нужно не только провести скрининг большого количества молекул-кандидатов, но и «ранжировать» наиболее перспективные соединения по силе связывания с мишенью. Определение аффинности также может быть полезно при разработке новых анализов и тест-систем.
Существует множество как качественных, так и количественных методов изучения аффинности. Качественные методы, такие как иммуноферментный анализ, биохимическая экстракция белков, гель-электрофорез и др., просто дают понять, происходит ли связывание в заданных условиях; это наиболее «грубая» оценка аффинности. Во многих же аспектах важно иметь информацию о силе того или иного межмолекулярного взаимодействия. На сегодняшний день для этих целей применяют самые разные количественные методы, но наиболее популярны четыре из них: изотермическая титрационная калориметрия, поверхностный плазмонный резонанс, интерферометрия биослоя и микроскопический термофорез. Рассмотрим эти методы подробнее.
Изотермическая титрационная калориметрия (ITC)
Это калориметрический метод, подразумевающий точное измерение теплоты, выделяющейся в результате взаимодействия. Типичный микрокалориметр содержит две ячейки, в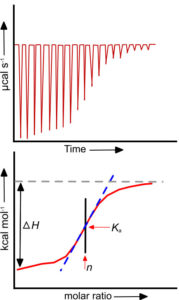 одной из которых осуществляется титрование лиганда аналитом, а другая выступает в качестве стандарта. Если титрант способен связываться с титруемым веществом, их взаимодействие сопровождается конкретным тепловым эффектом. Задача прибора – это непрерывное поддержание одинаковой температуры в двух ячейках и, соответственно, измерение необходимой для этого энергии. В результате количество теплоты, затраченное на выравнивание температур, представленное как функция от молярного отношения участников взаимодействия, позволяет определить константу диссоциации Kd. Также можно определить стехиометрию и термодинамические параметры реакции. Метод ITC впервые был коммерчески реализован в приборах MicroCal ITC от GE Healthcare.
одной из которых осуществляется титрование лиганда аналитом, а другая выступает в качестве стандарта. Если титрант способен связываться с титруемым веществом, их взаимодействие сопровождается конкретным тепловым эффектом. Задача прибора – это непрерывное поддержание одинаковой температуры в двух ячейках и, соответственно, измерение необходимой для этого энергии. В результате количество теплоты, затраченное на выравнивание температур, представленное как функция от молярного отношения участников взаимодействия, позволяет определить константу диссоциации Kd. Также можно определить стехиометрию и термодинамические параметры реакции. Метод ITC впервые был коммерчески реализован в приборах MicroCal ITC от GE Healthcare.
Данный метод удобен тем, что не требует ни введения специальных меток, ни иммобилизации одного из участников взаимодействия. Прозрачность и показатель преломления среды также не важны. Недостатком является то, что для проведения эксперимента необходимы большие объёмы образца, а также высокие концентрации лиганда и аналита, особенно если аффинность мала. Это может быть физически невозможным, например, в силу плохой растворимости субстратов. С точки зрения производительности, ITC уступает многим методам, поскольку одно титрование занимает по меньшей мере полчаса, то есть число экспериментов не превышает ~40 в сутки. Наконец, конструкция прибора не подразумевает наличие легко сменяемых элементов, поэтому важно регулярно очищать все его детали.
Поверхностный плазмонный резонанс (Surface Plasmon Resonance, SPR)
Поверхностный плазмонный резонанс – это эффект, возникающий в проводниковых материалах при попадании на них монохроматического излучения под определённым (резонансным) углом. При этом излучение поглощается проводником, и вблизи поверхности возникает электромагнитное поле, чувствительное к свойствам среды. Изменение свойств среды, например, когда на поверхности проводника иммобилизован лиганд и в проточную ячейку вводится молекула—аналит, приводит к изменению резонансного угла.
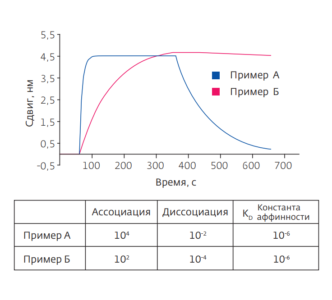
Ранее мы более подробно писали про природу данного явления и возможности метода на примере биосенсоров iMSPR от icluebio. Так, SPR-биосенсор позволяет с высокой точностью определять кинетические и термодинамические параметры взаимодействия (kon, koff, Kd, ΔG), осуществлять скрининг большого количества мишеней, изучать процессы ингибирования, проводить количественный и концентрационный анализ и др. Метод практически не имеет ограничений на природу субстратов: можно изучать взаимодействие белков, нуклеиновых кислот, различных мембранных систем (мицелл, липосом, моно/бислоев), вирусов как между собой, так и с низкомолекулярными соединениями. Эта технология является «золотым стандартом» определения аффинности взаимодействий биомолекул и находит широкое применение в клинической медицине, фармацевтике, биомедицине и биоинженерии.
SPR не требует введения специальных меток; это очень точный, быстрый и экономящий ресурсы метод, с помощью которого можно изучать практически любые взаимодействия между биомолекулами. Сложности, которые могут возникнуть при исследовании, связаны с необходимостью иммобилизации лигандов, а также с регенерацией поверхности биочипа, особенно если взаимодействие высокоаффинное. Важно учитывать также влияние показателя преломления среды на полученный результат.
Интерферометрия биослоя (BioLayer Interferometry, BLI)
Данная технология использует интерференцию белого света для анализа толщины слоя с иммобилизованным лигандом (биослоя) в присутствии разных аналитов. Так, по оптоволокну в BLI-сенсоре направляется пучок белого света к преломляющему слою; часть света отражается от этого слоя, а часть проходит до биослоя и отражается уже от его поверхности. При этом интенсивности, а также фазы колебаний волн, составляющих два отражённых пучка, отличаются, и эти волны интерферируют. Полученный интерференционный профиль в случае белого света – это зависимость интенсивности света от длины волны. Изменение в толщине биослоя будет влиять на разность хода волн в отражённых пучках, и, следовательно, на сам интерференционный профиль. Например, если происходит связывание, толщина слоя постепенно увеличивается, поэтому увеличивается разность хода волн – в результате профиль смещается в длинноволновую область спектра.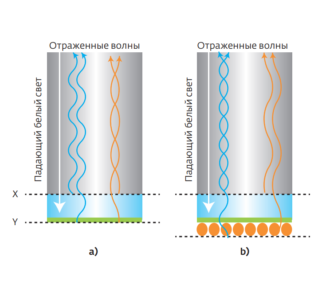
Аналогично, при диссоциации комплексов происходит смещение в коротковолновую область. Регистрируя этот сдвиг в режиме реального времени, получают кривые диссоциации, из которых определяют соответствующие константы скорости ассоциации/диссоциации (kon, koff) и константу диссоциации Kd. Наиболее известными в мире являются системы Octet производства Sartorius. Как и вышеописанные методы, BLI не требует введения специальных меток. BLI-сенсоры гораздо проще в использовании, чем SPR-системы, и при этом также обеспечивают высокую производительность. Однако с точки зрения чувствительности данный метод уступает SPR, и особенно это касается малых молекул—аналитов, поскольку в этом случае изменения в толщине биослоя очень малы. Кроме того, как и в SPR-биосенсорах, необходимо тщательно подбирать условия регенерации поверхности с иммобилизованным лигандом и соблюдать требования к буферным средам.
Микроскопический термофорез (Microscale Thermophoresis, MST)
Термофорез, или термодиффузия – это изменение концентрации молекул под воздействием градиента температуры, например, при точечном облучении раствора лазером. Это связано с тем, что малые частицы (например, молекулы растворителя) приобретают бóльшую скорость по сравнению с крупными частицами, и при соударении «выталкивают» их в область меньших температур. Если в растворе протекает какая-либо реакция, это легко обнаружить с помощью термофореза, поскольку образующиеся комплексы обладают большей массой и меньшей подвижностью, чем исходные вещества, и иным образом распределяются в объёме образца.
Детектирование осуществляют по интенсивности флуоресценции, то есть для этого необходимы либо лиганды с собственной флуоресценцией, либо лиганды с «пришитыми» к ним флуорофорами. Обычно проводят серию экспериментов с различными количествами нефлуоресцентных аналитов, поскольку в зависимости от числа связанных молекул интенсивность флуоресценции в области нагрева будет различаться. В итоге получают кривую зависимости доли образовавшихся комплексов от концентрации аналита; по этой кривой определяют константу диссоциации Kd. С помощью MST можно сделать выводы о возможных изменениях в сольватной оболочке, заряде комплексов, а также об их агрегации. Метод микроскопического термофореза был разработан компанией NanoTemper и реализован в системах Monolith.
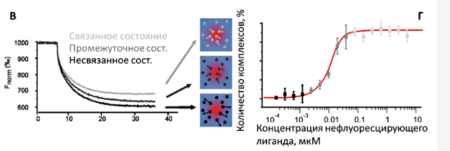
В отличие от SPR и BLI, для проведения эксперимента не нужна иммобилизация одного из партнёров. Это быстрый, точный и простой способ определения аффинности. К тому же, приборы для MST не требуют постоянной очистки и располагают большим количеством расходных материалов. С другой стороны, как уже было сказано, метод подразумевает измерение флуоресценции – это, скорее всего, потребует введения меток, а также создаст необходимость учитывать концентрационное и температурное гашение флуоресценции. К тому же, с помощью MST нельзя определить константы скорости ассоциации и диссоциации, а также исследовать термодинамику взаимодействия.
* * *
Естественно, что каждый из описанных методов обладает своими преимуществами и недостатками. При выборе подходящего для конкретной лаборатории оборудования необходимо руководствоваться не только кругом решаемых задач, но и сложностью в использовании и обслуживании. Для российских исследователей также важен вопрос доступности нового оборудования, обусловленный уходом многих ведущих компаний с рынка. Какие же решения доступны на данный момент?
В последние несколько лет в России набирают популярность южнокорейские биосенсоры SPR от компании icluebio. Их системы поверхностного плазмонного резонанса iMSPR смогли решить основные проблемы присущие этим приборам сделав их более компактными и доступными по цене, при этом сохраняя в себе точность, качество и производительность на уровне мировых производителей. Доступность для поставок в Россию и функциональность систем могут стать прекрасной заменой привычным системам Octet, ICT или Biacore.
